(nh4)2so4 Asam Atau Basa
Basa I Garam I Garam II Basa II. CH3COOH NH4OH NH4CH3COO H2O.
PH 7 e.

(nh4)2so4 asam atau basa. Oleh karena itu diperlukan pupuk yang dapat menjaga pH tanah agar tidak terlalu asam atau basa. Berikut ini adalah beberapa contoh reaksi pembentukan garam dikenal pula dengan istilah reaksi penggaraman atau reaksi netralisasi. Secara tidak langsung dapat dilakukan sebagai berikut.
Dalam contoh ini HNO3 adalah asam dan H2O bertindak sebagai basa NO3- disebut basa konjugasi dari asam HNO3 dan H3O adalah asam konjugasi dari basa H2O. Campuran yang menghasilkan garam terhidrolisis sebagian dan bersifat basa adalah. Ka2 sangat kecil sehingga H2CO3 tidak dapat dititrasi sebagai asam berbasa dua dengan cara langsung.
Campuran yang berasal dari asam kuat dan basa lemah membentuk garam yang mempunyai. Dan ion yg diikat garam yg berasal dari basa lemah 2. Protein yang telah mengalami denaturasi umumnya telah kehilangan fungsi biologinya meskipun rangkaian asam-asam.
Namun sifat garam ini adalah asam atau basa tidak netral sehingga pasti mengubah warga kertas lakmus. N 14 O 16 H 1 A. Besarnya OH- dalam 10 mL larutan yang mengandung 8 gram amonium nitrat adalah.
Asam I Garam I Garam Asam II. NH3 aq H2O NH4 aq OH-aq K 1810-5. Garam dapat terbentuk dari reaksi antara asam dan basa.
Dalam contoh ini NH3 adalah basa dan H2O bertindak sebagai asam. Ion Cu2 ini memiliki bilangan koordinasi 4 yang berarti terdapat empat buah ruangan yang tersedia di sekitar atom 2Cu2 yang dapat diisi oleh sebuah ligan pada masing-masing ruangan. Reaksi hidrolisis yang terjadi bila ammonium klorida dilarutkan dalam air adalah.
50 mL HCOOH 02 M 50 mL KOH 02 M. HCl aq NaOH aq NaCl aq H2O l H2SO4 aq 2 NH4OH aq NH42SO4 aq 2 H2O l 2 HCN aq Ba OH2 aq Ba CN2 aq 2 H2O l. NH3 H2O NH4OH H D.
Kb NH4OH 10-5 Ar. PH 7 c. PH 3 d.
50 mL HCl 02 M 50 mL NH3 02 M c. 11 Latar Belakang Garam merupakan hasil reaksi antara 14 Teori asam dan basa reaksinya ialah Garam merupakan senyawa yang reaksinetralisasi. Cl- H 2O HCl OH -C.
Protein yang telah dikoagulasikan tidak dapat larut dalam air atau dengan pendinginan karena telah mengalami perubahan irreversibel yang disebut denaturasi. No Rumus Garam Uji Lakmus Merah Biru 1 NaCl. Sejumlah asam dan umumnya merupakan hasil reaksi asam basa murni ekuivalen yang dicampur dan dan basayang dapat bersifat asam basa.
NH42SO4 NH4OH H2SO4 BL AK bersifat asam Na2SO4 NaOH H2SO4 BK AK bersifat netral tidak mengubah warna kertas lakmus. NH4 adalah asam konjugasi dari basa NH3 dan OH-adalah basa konjugat dari asam. PH 0 b.
Biasanya para petani menggunakan pelet padat NH42SO4 untuk menurunkan pH tanah. NH4 H2O NH4OH H B. NH4 H2O NH4OH 2H E.
50 mL CH3COOH 02 M 50 mL NaOH 01 M b. NH42SO4 berasal dari basa lemah dengan asam kuat yg kuat asam berarti bersifat asam maka yang dicari konsentrasi ion H. Jadi larutan penyangga dibuat dari larutan yang mengandung baik asam lemah atau basa lemah dan garamnya.
Dan ion yg diikat garam yg berasal dari basa lemah 2. Pada garam rangkap CuSO4NH42SO46H2O yang menjadi ion pusat adalah Cu2 sedangkan yang menjadi ligannya adalah SO 42- dan NH4. NH4Cl H2O NH4OH OH- 5.
Reaksi Ionisasi Garam dari Asam Lemah dan Basa Lemah. Contoh garam yang berasal dari asam lemah dan basa lemah diantaranya adalah NH 4 CN NH 4 2 CO 3 CH 3 COONH 4. 4125 g Pembahasan.
Kami akan menyelidiki sifat asam basa atau netral darilarutan NaCl MgSO4 NH4Cl NH42SO4 Na2CO3 NaCH3COONH4CH3COO dan NH4C2O4dengan kertas lakmus merah lakmus birudan indikator universalPada percobaan pertama kami memasukan garam dari asamkuat-basa kuat yaitu larutan NaCl ke dalam tabung reaksi kemudianmemasukan kertas lakmus merah ke dalam. Garam NH42SO4 bersifat asam ion NH4 akan terhidrolisis dalam tanah membentuk NH3 dan H yang bersifat asam. Analisis pH suatu larutan garam.
Natrium asetat CH3COONa dapat dibuat ari asam dan basa yang sesuai. NH 4 CN aq NH 4 aq CN aq Reaksi Kesetimbangan Ion Garam dari Asam Lemah dan Basa Lemah Dalam Air. NaOH NH42SO4 2NH4OH Na2SO4.
Jadi pada garam rangkap CuSO4NH42SO46H2O dua buah. LiCH3COO Untuk menjawab pertanyaan tersebut mari kita telaah lebih lanjut mengenai beberapa hal yang menjadi garam. H3PO4 NH4F NH43PO4 3HF.
Jika diketahui pH NH42SO4 5 Kb NH4OH 10-5 dan Mr NH42SO4 132 massa amonium sulfat yang harus dilarutkan dalam 250 mL air adalah. BAB I CuSO4NH42SO4xH2O dan garam PENDAHULUAN kompleks tetraamintembagaII sulfat hidrat CuNH34SO4xH2O. Untuk mengetahui sifat suatu garam apakah asam basa atau netral maka kita harus menghitung pH dari larutan tersebut.
Larutan protein dapat diendapkandikoagulasikan dengan penambahan larutan pekat NaCl MgSO4 NH42SO4 alkohol aseton asam dan basa atau dengan pemanasan 100C. Berikut ini adalah hasil uji sifat asam atau basa dari beberapa garam. CH3COOH NaOH CH COONa Garam basa lemah mempunyai kation dengan basa seperti amonium hidroksida NH4OH dengan garamnya yaitu NH4Cl NH42SO4.
Asam Lemah Basa Lemah Garam Air.

Garam Amonium Sulfat Nh4 2so4 Dibuat Dengan Mencampurkan 100 Ml Nh4oh 0 01 M Dengan 100 Ml H2so4 Brainly Co Id

Pin Oleh Deew Aisyah Di Kutipan Pelajaran Hidup Di 2021 Kutipan Pelajaran Hidup Kutipan Pelajaran Pelajaran Hidup

Asam Basa Dan Garam Teori Ciri Sifat Dan Indikator

Cara Menghitung Valensi Garam Seperti Nh4 2so4 Kenapa Valensinya Bisa 2 Brainly Co Id

Hidrolisis Garam Pptx Powerpoint
Tuliskan Rumus Asam Dan Basa Pembentuk Garam Garam

Hidrolisis 1 Dari Campuran Garam Berikut Ini Yang
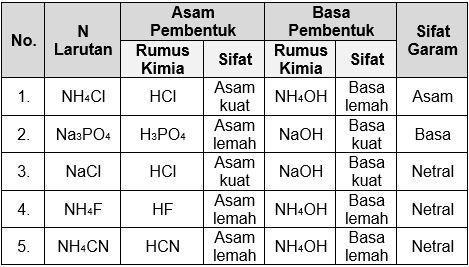
Tuliskan Rumus Asam Dan Basa Pembentuk Garam Garam

2 4 Hidrolisis Garam Total Nh4 2co3 Sifat Ph Asam Basa Penyusun Kimia 11 Bakul Pulsa Youtube